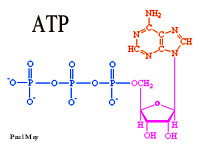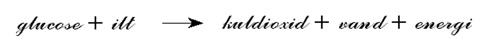
viser den kemiske reaktion, der leverer energi til alle stofskifteprocesser i cellerne i kroppen.
Kemisk er der tale om en forbrændingsproces, hvori atmosfærisk ilt reagerer med glucose og processen udvikler energi.
Foregår forbrændingsprocessen i et reaktionskammer (reagensglas eller lign) - uden for celler, frigøres al den kemiske energi i glucosemolekylet som varme.
I celler derimod foregår reaktionen trinvis, således at cellen dels kan styre forbrændingen og dels sættes i stand til at udnytte energien fra delreaktionerne.
En del af den kemiske energi, der er bundet i glucosemolekylet, frigøres stadig som varmeenergi, medens resten bindes i en for cellen anvendelig energiform - ATP (se også Fysiologikompendium side 6 ).